Периодический закон Д.И.Менделеева. Часть 1.
20 декабря 2017 года в ходе заседания 72 сессии Генеральной ассамблеи ООН было принято решение о том, что 2019 год станет Международным годом Периодической таблицы химических элементов. Ранее эта идея была выдвинута Российской Федерацией в рамках ЮНЕСКО. Этот замысел поддержали более 150 мировых научных центров. В 2019 году исполнилось 150 лет со дня сдачи в типографию рукописи – первого варианта периодической таблицы.
А как все начиналось?
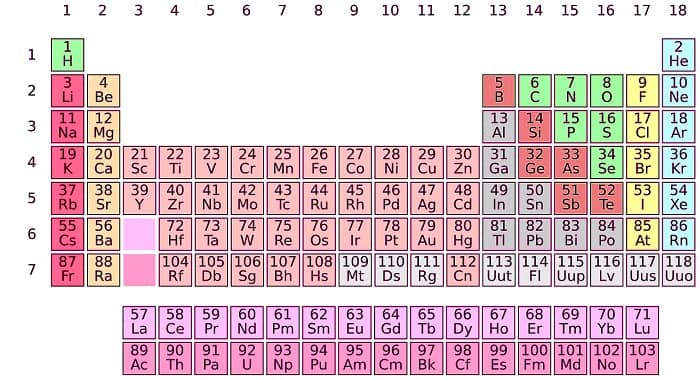
В то время, когда Менделеев работал над созданием закона было известно 63 элемента. Много это или мало ? Если учесть что сейчас их в таблице 118, можно сказать с уверенностью, что тогда для анализа сведенеий об элементах информации было маловато. Но ученому достаточно было и этого, чтобы подметить закономерности изменения их свойств.
Предпринимались ли попытки до Менделеева систематизировать знания об элементах? Конечно, да. В 1829 году немецкий химик Иоганн Вольфганг Деберейнер сгруппировал элементы со сходными химическими свойствами по тройкам, назвав их триадами. В истории химии они известны как «триады Деберейнера». Например, в одной триаде находились –литий, натрий, калий, в другой — хлор, бром, йод и т.д. Ученый заметил, что если расположить эти элементы в триадах по мере возрастания их атомных масс, то атомная масса среднего элемента окажется равной среднему арифметическому атомных масс первого и третьего элементов.
В 1862 году французский геолог и химик Александр-Эмиль Бегье де Шанкуртуа предложил систему элементов в виде спиральной линии на поверхности цилиндра. В спирали на каждом витке располагалось по 16 элементов. Сходные элементы находились друг под другом на образующей цилиндра.
В 1866 году английский химик Джон Александр Ньюлендс выступил с идеей закона октав. Он утверждал, что все в мире подчиняется общей гармонии, она должна быть единой для всех граней жизни. Ученый искал связь химии с музыкой и утверждал, что свойства химических элементов, расположенных по возрастанию их атомных масс, должны повторяться через каждые семь элементов, аналогично музыкальным звукам в октаве, где через каждые семь нот, восьмой звук повторяет первый, но с более высоким или более низким тоном. По закону октав, однако, оказались сходными такие различные по свойствам элементы как углерод и ртуть.
Ближе других к истине оказался немецкий химик Юлиус Лотар Мейер. Он создал таблицу, в которой все известные элементы были разбиты на шесть групп, согласно их валентности. По внешнему виду таблица Мейера немного напоминала будущую менделеевскую. Мейер опубликовал свою идею практически одновременно с Менделеевым, поэтому оба ученых получили в 1882 году престижную награду Лондонского королевского общества — Медаль Дэви, ее можно считать предшественницей Нобелевской премии.
И все же суд истории по праву присудил приоритет открытия закона периодичности Менделеву. Почему? Менделеев всю жизнь провел в химических лабораториях, хорошо знал, как выглядят вещества на практике, как плавятся, затвердевают, пахнут, реагируют, каковы свойства их соединений. Естественно, он изучил опыт своих предшественников, опираясь на то, самое ценное, что уже было подмечено его коллегами. Кроме того, он постоянно работал со своей таблицей, меняя, исправляя ошибочное.
17 февраля по старому стилю 1869 года, собираясь в дорогу, профессор Петербургского университета Дмитрий Иванович Менделеев, на обратной стороне письма, в котором его просили приехать и помочь производству, сделал первый набросок таблицы.
В тот день Менделеев отложил свою поездку. Он подготовил отдельные небольшие карточки со всеми известными элементами и их основными физическими и химическими свойствами. Располагая карточки в различном порядке, сообразуясь с атомными весами элементов, их свойствами и свойствами их соединений, Менделеев составил первый вариант системы химических элементов. Он назвал его «Опыт системы элементов, основанном на их атомном весе и химических свойствах».
1 марта 1869 года ученый разослал своим русским и зарубежным коллегам отпечатанный в виде таблички «Опыт системы…» Первый вариант, естественно, требовал доработки, он далек от нынешнего внешнего вида, но он был первой графической иллюстрацией периодического закона. Правда, в этой статье Менделеев не упомянул термин «периодический закон», понимая, что для этого нужны доказательства. Ученому было тогда 35 лет.
Первое сообщение об открытии было сделано 6 марта 1869 года на заседании Русского химического общества. Автор закона отсутствовал, доклад от его имени прочитал химик Николай Александрович Меншуткин. Вот как сам Менделеев охарактеризовал творческий процесс: « …..невольно зародилась мысль, что между массой элементов и их химическими свойствами должна быть связь. А так как масса вещества, хотя и не абсолютная, а лишь относительная, выражается окончательно в виде веса атомов, то надо искать функциональное соответствие между индивидуальными свойствами элементов и их атомными весами.
Искать что-либо, хотя бы грибы или какую либо зависимость нельзя иначе, как смотря и пробуя. Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и коренными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства химических элементов стоят в периодической зависимости от их атомного веса. Причем, сомневаясь во многих неясностях, я ни минуты не сомневался в общности сделанного вывода.
Было бы не совсем точно сказать, что Менделев расположил известные элементы по возрастанию их атомных весов. Если бы он сделал так, то никакого закона он бы не открыл, так как многие атомные массы были неточными. Скорее наоборот, ученый внес поправки в этивеличины на основе открытого им закона. Например, он установил правильный атомный вес бериллия, что позже было подтверждено экспериментами.
Занимаясь построением таблицы, он учитывал не только атомные массы элементов, но и их свойства, а также свойства их соединений. Так, под карточкой натрия он разместил карточку со знаком калия, как похожего по свойствам , активного металла, причем натрий и калий открывали новые ряды или периоды. За натрием следует магний, как менее активный металл и элемент с большим атомным весом, чем натрий. Под магнием ученый кладет карточку с кальцием, как сходного по свойствам элемента с магнием, а по атомной массе большей, чем калий.
Следующим в порядке возрастания атомного веса должен был идти ванадий, но его карточка осталась в стороне, а рядом с кальцием появляется пустая карточка. С точки зрения химика, это был странный и не совсем понятный поступок. Можно ожидать, что после пустой карточки, все-таки появится карточка с ванадием, но вместо него Менделеев кладет листок с титаном, у которого ученый осмеливается не проведя никаких исследований и вопреки всему тому, что было уже известно к тому моменту о титане, исправить его атомный вес с 54 на 48. После чего, наконец, за титаном следует карточка ванадия, а за ним- хрома и марганца.